《高考化学小题狂做·基础篇》
P14第14题
解析:
(3)因为是NaHSO3中逐滴加入NaIO3,NaHSO3先是过量的,由图可知A点之前是NaHSO3与NaIO3反应生成I-(IO3-+3HSO3-+3H2O==I-+3SO42-+9H+ ?);到A点NaHSO3恰好反应完全,此时5 mol NaHSO3全部转化为SO42-,硫元素由+4价升高到+6价,失去电子数为5 mol×2e-=10 mol,AB段是生成单质I2(IO3-+6H++5I-==3I2↓+3H2O ‚),又I-与I2物质的量之比为5:3,设IO3-的物质的量为x,由由碘元素守恒知,IO3-完全转化为I-和单质I2,
IO3-~ I-~ 6e-
IO3-~  I2~ 6e-【由碘元素守恒得到,因为IO3-除了转化为I-外,就是转化为I2,可以认为IO3-+3HSO3-→I-+I2+3SO42-】
I2~ 6e-【由碘元素守恒得到,因为IO3-除了转化为I-外,就是转化为I2,可以认为IO3-+3HSO3-→I-+I2+3SO42-】
即IO3-得电子总数为n(IO3-)×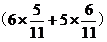 【由IO3-转化为I-和转化为I2的比例得到,I-与I2物质的量之比为5:3,则有
【由IO3-转化为I-和转化为I2的比例得到,I-与I2物质的量之比为5:3,则有 的IO3-转化为I-,有
的IO3-转化为I-,有 的IO3-转化为I2】
的IO3-转化为I2】
IO3-得电子总数=NaHSO3失去电子总数,
n(IO3-)×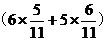 =10 mol
=10 mol
解得n(IO3-)=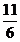
这种方法比较难理解,但是计算快。
另外可以一步一步来,下面的方法比较简单
(3)因为是NaHSO3中逐滴加入NaIO3,NaHSO3先是过量的,由图可知A点之前是NaHSO3与NaIO3反应生成I-(IO3-+3HSO3-+3H2O==I-+3SO42-+9H+ ?);到A点NaHSO3恰好反应完全,此时5 mol NaHSO3全部转化为SO42-,硫元素由+4价升高到+6价,失去电子数为5 mol×2e-=10 mol,
IO3- + 3HSO3-+3H2O==I-+ 3SO42-+9H+
1 3 3
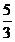 mol 5mol
mol 5mol 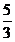 mol
mol
5 mol NaHSO3全部转化为SO42-时消耗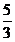 mol IO3- ,得到
mol IO3- ,得到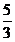 mol I- ,
mol I- ,
AB段是生成单质I2(IO3-+6H++5I-==3I2↓+3H2O ‚),又I-与I2物质的量之比为5:3,设A点之后消耗IO3-的物质的量为x,由碘元素守恒知,IO3-完全转化为I-和单质I2,
IO3-+ 6H++5I-== 3I2↓+3H2O
x 5x 3x
A点之后消耗IO3-的物质的量为x,则生成I2物质的量为3x,I-物质的量=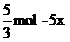 ,
,
列式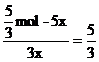 ,解得x=
,解得x= mol,
mol,
则消耗NaHSO3的物质的量总和为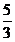 mol+
mol+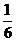 mol=
mol=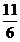 mol。
mol。

微信小程序
微信扫一扫体验

微信公众账号
微信扫一扫加关注
评论 返回
顶部

发表评论 取消回复